
11.结合如图回答下列问题
(1)镁离子的符号是 Mg2+ ;
(2)X的值为 12 ;
(3)镁元素位于元素周期表中第 3 周期.

【分析】(1)根据当质子数=核外电子数,为原子;若原子的最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子,进行分析解答.
(2)根据当质子数=核外电子数,为原子,进行分析解答.
(3)根据周期数=【解答】解:(1)当质子数=核外电子数,为原子;X=2+8+2=12,为镁元素的原子;最外层电子数是2,在化学反应中易失去2个电子而形成带2个单位正电荷的阳离子,其离子符号为:Mg2+.
(2)根据当质子数=核外电子数,为原子;X=2+8+2=12.
(3)周期数=原子核外电子层数,镁元素位于元素周期表中第3周期.
故答案为:(1)Mg2+;(2)12;(3)3.
12.用化学知识可以解决厨房中的许多问题,如:
(1)提倡食用铁强化酱油,可以预防 贫血(或缺铁性贫血) ;
(2)用洗洁精清洗碗上的油污,利用了 乳化 原理;
(3)除去冰箱中的异味,常用 活性炭 吸附;
(4)发现电水壶中有较多水垢,用厨房中的 食醋 清洗.
【考点】微量元素、维生素与健康的关系及摄取方法;乳化现象与乳化作用;盐的化学性质;碳单质的物理性质及用途.
【分析】(1)根据铁元素与人体健康的关系来分析;
(2)根据洗洁精洗油污的过程考虑;
(3)根据活性炭具有吸附性来分析;
(4)根据水垢的主要成分是碳酸钙,能与酸反应,进行分析判断.
【解答】解:(1)铁是人体必(2)洗洁精洗去餐具上的油污是利用洗洁精能将油滴的大颗粒分解成小的油滴,便于被水冲走,属于乳化原理,故填:乳化;
(3)活性炭具有吸附性,可以用活性炭来吸附冰箱中的异味;故填:活性炭;
(4)水垢的主要成分是碳酸钙,能与酸反应,可用食醋除去电水壶中的水垢,故填:食醋.
13.如图是硝酸钾的溶解度曲线,回答下列问题:
(1)硝酸钾的溶解度随温度升高而 增大 ;
(2)当温度为 60 ℃时,硝酸钾的溶解度为110g;
(3)图中点A所对应的是该温度下硝酸钾的 不饱和 (填“饱和”或“不饱和”)溶液.
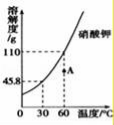
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:(1)通过分析溶解度曲线可知,硝酸钾的溶解度随温度升高而增大;
(2)当温度为60℃时,硝酸钾的溶解度为110g;
(3)图中点A所对应的是该温度下硝酸钾的不饱和溶液.
故答案为:(1)增大;
(2)60;
(3)不饱和.
三、解答题(共7小题,满分30分)
14.某物质R在氧气中燃烧的化学方程式为R+2O2(1)R的化学式为 CH4 ;
(2)CO2中碳元素的化合价为 +4 .
【考点】质量守恒定律及其应用;有关元素化合价的计算.
【分析】(1)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物R的化学式;
(2)根据在化合物中正负化合价代数和为零,结合二氧化碳的化学式进行解答本题.
【解答】解:(1)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式R+2O2(2)氧元素显﹣2价,设碳元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(﹣2)×2=0,则x=+4价.
故答案为:(1)CH4; (2)+4.
 ,我们将会及时处理。
,我们将会及时处理。