
三、解答题(共5小题,满分40分)
16.(8分)根据要求回答下列问题
(1)用化学用语表示:①碱溶液中的阴离子 ;②氯化铵中氮元素的化合价 。
(2)生活中常用铁锅炒菜:
①用铁锅炒菜。主要利用了铁的性质是 (填字母序号)。
A.导电性 B.导热性C.有金属光泽 D.延展性
②炒菜时,油锅中的油不慎起火。可用盖锅盖的方法灭火,此方法利用的灭火原理是 。
③铁锅的硬度较纯铁 (填大或小),为了防止铁锅生锈,你给他的建议是 。
④用铁锅烹饪食物时,会有少量铁屑在胃部(胃酸为盐酸)转化为可被吸收的Fe2+,反应的化学方程式为 ,人体补充铁元素,可预防 症。
17.(7分)A、B、C、D、E、H等是初中化学中常用到的几种物质。它们之间发生如图变化,其中A是氧化物,可作干燥剂;D是一种盐,用于制造玻璃洗涤剂等。请你根据所学知识作出推断:
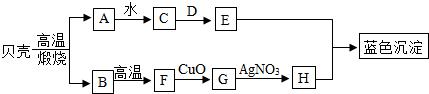
(1)A 、D (均用化学式表示)。
(2)贝壳的主要成分是 (写名称),贝壳高温煅烧的化学方程式 。
(3)B→F的化学方程式 。
(4)G→H基本反应类型是 。
(5)C的用途是 。
18.(11分)根据下列实验装置图,回答有关问题。

(1)仪器名称:① 。
(2)实验室常用稀盐酸与大理石反应来制取和收集CO2,可选用的装置组合是 (填序号),反应的化学方程式为 。C装置相对于B的优点有 。
(3)实验制得的CO2中常含有少量H2O和HCl,通过如图(F﹣G)装置可获得纯净、干燥的CO2.其中F装置中放入 可除去HCl,G装置中放入 试剂可除去水蒸气。
检验H装置中集气瓶里CO2已集满的方法是 。
(4)实验室里在A装置中利用KClO3和MnO2制备O2,其反应的化学方程式为 。
反应后二氧化锰在固体混合物中质量分数较反应前 (填“变大”、“变小”或“不变”)。
(5)实验室用块状电石与水在常温下反应制取乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂你认为上图中最适合制取乙炔气体的发生装置是 ;乙炔在空气中燃烧产生的火焰称为“氧炔焰”,可用来切割和焊接金属。故为了防止乙炔气体在点燃时发爆炸,点燃前一定要进行 操作。
19.(8分)实验室里NaOH固体必须密封保存,其原因之一是(用方程式表示) ;
现实验室里有一包白色NaOH样品,某兴趣小组同学为了确定这样品的成分,对其可能的组成进行了下列探究。
(1)【猜想】依据所学知识,兴趣小组同学对这种白色粉末的成分作了如下猜想:
①可能没有变质,全是NaOH;②可能完全变质,全是Na2CO3;你认为还有一种可能是 。
(2)【实验】为了验证猜想,他们做了下面实验:
实验一:取少量白色粉末溶于水,向所得溶液里滴加酚酞试液,溶液变为红色。
实验二:取少量白色粉末,滴加稀盐酸,有气体生成。
(3)【结论】由上述实验过程和实验现象,分析得到下面结论。
结论一:由实验一得到的结论是白色粉末是NaOH.你认为该结论 (填“正确”或“不正确”)。
综合分析上述两个实验,你得到的结论是:
(4)【继续探究】兴趣小组同学在分析和研究了上述实验及实验结论后,为了确认白色粉末的成分,查阅资料并做了下面的实验三:取少量白色粉末溶于水,向所得溶液里滴加过量的BaCl2试液,有白色沉淀产生(反应的方程式为Na2CO3+BaCl2=BaCO3↓+2NaCl)…
①你认为滴加过量BaCl2试液的目的是 ; ②如何判断BaCl2试液已经过量? ;
③你认为还应继续加 ,若 ,则说明原NaOH固体已经完全变质。
20.(6分)某校化学兴趣小组欲用4.9%的稀H2SO4,测定一瓶标签破损的 NaOH溶液的溶质质量分数。
(1)欲配制100g4.9%的稀硫酸溶液,需用98%的浓硫酸 g。
(2)取10g NaOH溶液样品与4.9%的稀硫酸溶液混合,溶液中pH变化如图所示。当加入稀硫酸质量小于20g时,混合溶液中的溶质为 (填化学式)。
(3)求NaOH溶液样品中溶质的质量分数。

 ,我们将会及时处理。
,我们将会及时处理。