2016教师资格考试高中《化学学科》必背知识(一)
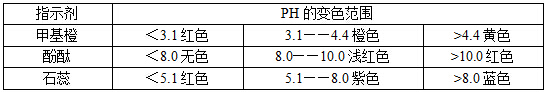
1、常用酸、碱指示剂的变色范围:
2、在惰性电极上,各种离子的放电顺序:
阴极(夺电子的能力):Au3+ >Ag+>Hg2+ >Cu2+ >Pb2+ >Fa2+ >Zn2+ >H+ >Al3+>Mg2+ >Na+ >Ca2+ >K+
阳极(失电子的能力):S2- >I- >Br– >Cl- >OH- >含氧酸根
注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)
3、双水解离子方程式的书写:
(1)左边写出水解的离子,右边写出水解产物;
(2)配平:在左边先配平电荷,再在右边配平其它原子;
(3)H、O不平则在那边加水。
例:当Na2CO3与AlCl3溶液混和时: 3 CO32- + 2Al3+ + 3H2O = 2Al(OH)3↓ + 3CO2↑
4、写电解总反应方程式的方法:
(1)分析:反应物、生成物是什么;(2)配平。
例:电解KCl溶液:2KCl + 2H2O == H2↑+ Cl2↑+ 2KOH
5、将一个化学反应方程式分写成二个电极反应的方法:
(1)按电子得失写出二个半反应式;(2)再考虑反应时的环境(酸性或碱性);(3)使二边的原子数、电荷数相等。
例:写出作为原电池(放电)时的电极反应。
写出二个半反应: Pb –2e- → PbSO4 PbO2 +2e- → PbSO4
分析:在酸性环境中,补满其它原子,应为:
负极:Pb + SO42- -2e- = PbSO4
正极: PbO2 + 4H+ + SO42- +2e- = PbSO4 + 2H2O
注意:当是充电时则是电解,电极反应则为以上电极反应的倒转:
为: 阴极:PbSO4 +2e- = Pb + SO42- 阳极:PbSO4 + 2H2O -2e- = PbO2 + 4H+ + SO42-
6、在解计算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等。用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法 和估算法。(非氧化还原反应:原子守恒、电荷 平衡、物料平衡用得多,氧化还原反应:电子守恒用得多)
7、电子层结构相同的离子,核电荷数越多,离子半径越小。
8、晶体的熔点:原子晶体 >离子晶体 >分子晶体
中学学到的原子晶体有: Si、SiC 、SiO2和金刚石。
原子晶体的熔点的比较是以原子半径为依据的: 金刚石 > SiC > Si (因为原子半径:Si> C> O)。
9、分子晶体的熔、沸点:组成和结构相似的物质,分子量越大熔、沸点越高。
10、胶体的带电:一般说来,金属氢氧化物、金属氧化物的胶体粒子带正电,非金属氧化物、金属硫化物的胶体粒子带负电。
11、含有Fe3+的溶液一般呈酸性。
12、能形成氢键的物质:H2O 、NH3 、HF、CH3CH2OH 。
13、氨水(乙醇溶液一样)的密度小于1,浓度越大,密度越小,硫酸的密度大于1,浓度越大,密度越大,98%的浓硫酸的密度为:1.84g/cm3。
14、离子是否共存:(1)是否有沉淀生成、气体放出;(2)是否有弱电解质生成;(3)是否发生氧化还原反应;(4)是否生成络离子[Fe(SCN)2、Fe(SCN)3、Ag(NH3)+、[Cu(NH3)4]2+ 等];(5)是否发生双水解。
15、气体溶解度:在一定的压强和温度下,1体积水里达到饱和状态时气体的体积。
联系电话:4000-525-585 课程咨询微信号:W712931601。快速联系通道
热点推荐:教师资格证报名时间及报名入口 教师资格证报考条件 中小学教师资格证考试网:教师资格证报名官网 中国教师资格网
中小学幼儿园教师资格考试大纲(最新) 2016中小学教师资格考试合格证书补办 2016年中小学教师资格证书查询入口
一级建造师二级建造师消防工程师造价工程师土建职称公路检测工程师建筑八大员注册建筑师二级造价师监理工程师咨询工程师房地产估价师 城乡规划师结构工程师岩土工程师安全工程师设备监理师环境影响评价土地登记代理公路造价师公路监理师化工工程师暖通工程师给排水工程师计量工程师
执业药师执业医师卫生资格考试卫生高级职称护士资格证初级护师主管护师住院医师临床执业医师临床助理医师中医执业医师中医助理医师中西医医师中西医助理口腔执业医师口腔助理医师公共卫生医师公卫助理医师实践技能内科主治医师外科主治医师中医内科主治儿科主治医师妇产科医师西药士/师中药士/师临床检验技师临床医学理论中医理论